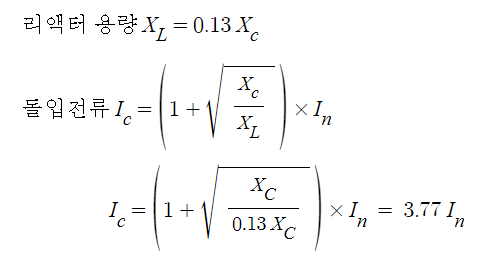
51. 0.2M - NH4OH 의 pH는 ? (단, 0.2M -NH4OH 용액의 이온화도는 0.01이고, log2 = 0.3 이다.) ① 10 ② 10.5 ③ 10.8 ④ 11.3 [풀이] [OH-] = [몰농도] × (염기의 기수) × (이온화도) = 0.2 × 1 × 0.01 = 2 × 10-3 52. 0.001 M, HCl 용액의 pH는 얼마인가 ?
① 1 ② 2 ③ 3 ④ 4 [풀이] pH = - log [H+] = -log (1 × 10-3) = 3 53. 수산화 이온농도가 2.0 × 10-3 M인 암모니아 용액의 pH는 얼마인가 ?
(단, log2=0.3) ① 10.3 ② 11.3 ③ 12.20 ④ 12.3 [풀이] pOH = -log [2.0 × 10-3] = 2.7 pH = 14.00 - pOH = 14.00 - 2.7 = 11.3 54. pH 4인 용액과 pH 6인 용액의 농도차는 얼마인가 ? ① 1.5 배 ② 2배 ③ 10배 ④ 100배 [풀이] pH 4 = 10-...
#몰농도
#헨리법칙
#중량백분률
#전기분해
#이온농도
#원자번호
#용해도
#삼투압
#산화물
#산화
#반감기
#몰분율
#몰랄농도
#환원
원문링크 : 일반화학 및 유체역학 출제예상문제 - 2