1. 가역반응과 비가역 반응 가.
가역반응 정반응(반응물에서 생성물)과 역반응(생성물에서 반응물)이 모두 일어나는 반응 나. 모든 화학반응 : 원론적으로 가역반응 다.
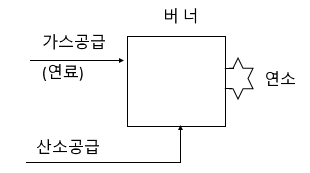
비가역 반응 역반응이 너무 느리거나 조금 일어나서 정반응만 일어나는 것 처럼 보이는 반응 ※ 비가역 반응의 예로 이온결합 물질이 침전되는 경우로 이 앙금은 물에 잘 녹지 않아 앙금이 생기는 것이 므로 역반응이 거의 일어나지 않는다. 이 앙금의 경우에는 10-15 비율로 역반응이 일어난다. ※ 강산과 강염기가 만나 중화반응을 하는 경우로 강산과 강염기는 100[%] 이온화 할 수 있는 물질이고 이온화하여 H와 OH가 만나 물이 되는데 물은 자연상태에서 오억5천오백만개 중의 하나만 역반응이 일어난다.
약산인 아세트산 (CH3COOH)은 1.3[%] 만 이온화되어 불안정하다. 즉, 약산이 들어 있는 물질의 중화반응은 불안정하여 물을 쪼개서 원래의 산으로 가려는 성향이 있어 가역 반응을 한다. ※ 비가역 반응에는 기체 생...
#가역반응
#헤스의법칙
#평형상수
#촉매
#정촉매
#이온화평형
#용해도곱
#열화학반응식
#열량
#부촉매
#반응속도
#르샤틀리에
#화학평형
원문링크 : 반응속도와 화학평형